actualité
L'évolution rapide de la grippe aviaire fait craindre une « pandémie sévère »
Tous nos articles
Santé
Quand la photographie est la littérature de l'œil.
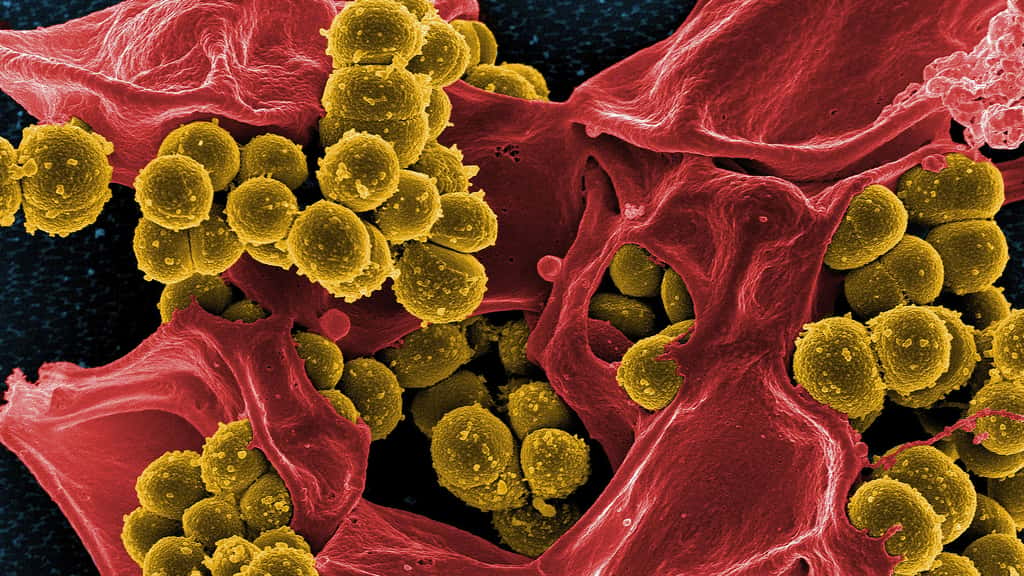
Santé
Maladie
Sponsorisé
Nos
Chaque semaine, nos journalistes vous font découvrir le monde autrement, leurs regards et leurs expertises nous rapprochant des multiples curiosités scientifiques.
Tous les experts